鋰電池關鍵材料
鋰離子電池(Lithium Ion Batteries; LIBs)由許多元件所構成,包含正極材料、負極材料、電解質、隔離膜、銅鋁箔集電層,如圖二所示。正極材料結構有層狀結構Layer( 如LiCoO2) 、尖晶石結構Spinel(如LiMn2O4)、橄欖石結構Olivine(如LiFePO4);負極材料如石墨、錫合金、鋰金屬、鋰鈦氧化物;電解質包含液態溶劑、固態陶瓷、膠態高分子、離子液體;隔離膜主要由PE 、PP 成分所組成的多孔性薄膜。圖二為液態電解質進行放電過程,鋰離子由負極嵌入正極,中間經過電解液形成離子化溶劑(Solvent-ion),促進鋰鹽解離並增加導電度。正負極氧化還原反應如下:
Anode:
LixC6 → xLi+ + C6 + xe-
Cathode:
xLi+ + xe- + CoO2 → LiCoO2
1. 正極材料
鋰電池開發初期大多採用層狀結構的鋰鈷氧化物(LiCoO2)及鋰鎳氧化物(LiNiO2)、尖晶石結構的鋰錳氧化物(LiMn2O4),如表一所示,但結構不穩定且有毒性,因此後來的研究方向改變成加入過渡金屬元素,製備出二元或三元正極材料來改善結構不穩定的缺點,如鋰鎳鈷氧化物(LiNixCoyO2)、鋰鎳錳氧化物(LiNixMnyO4)及鋰鎳鈷錳氧化物(LiNixCoyMnzO2)之極板。直到1996 年,美國德州大學John B.教授成功開發出具有橄欖石結構的磷酸鋰鐵(LiFePO4),其結構穩定性高、循環壽命佳及安全性高,而且鐵元素價格較鈷、錳元素價格便宜,最近成為熱門的正極材料。
4. 電解質
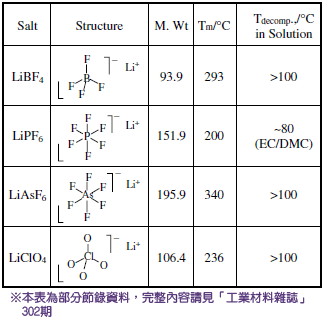
電解質材料開發須包含高導電度(>10-3 S/cm)、穩定電化學特性、低揮發性、阻燃、無毒及低成本等特性。電解質是由鋰鹽及溶劑(或分散劑)所組成,依據電解質形態可區分為液態、膠態、固態,如表二所示。目前市場主流以液態電解液有機碳酸酯為主,液態電解質又可區分成有機碳酸酯及離子液體,溶劑多為環狀碳酸酯類(如EC 、PC)及鏈狀碳酸酯類(如DMC 、DEC 、EMC),優點為具有高導電度、操作溫度範圍廣;缺點為容易漏液而爆炸起火。固態電解質區分為高分子及玻璃陶瓷,優點為安全性佳、不需隔離膜以降低成本;但缺點為導電度極小。
表三、常見鋰電池之鋰鹽物理性質
電解液市場分析
鋰電池是由許多材料所組合而成,以電動車所使用之動力鋰電池為例,各個材料成本分析如圖四所示。其中正極材料占生產成本的45% 最多,其次為電解液25% ,負極與隔離膜分別為13 % 及8% 。目前許多學者致力於開發隔離膜技術,設法降低隔離膜成本,避免技術掌握在特定廠商手中,隔離膜成本降低有助於鋰電池整體成本下降,使鋰電池使用更普及。另外,動力鋰電池所需電解液遠大於3C 電池,成本控制格外重要。電解液主要成分是鋰鹽及溶劑,鋰鹽占整體電解液成本之45% ,其次為溶劑占30% 。
鋰電池安全性
改善鋰電池安全性前提須對電池內部化學反應有所了解,電池充放電過程中有許多副反應發生,會直接影響鋰電池電性,造成循環壽命減短,副反應包含以下幾種:1.SEI 膜無限制成長:SEI 膜過多會使極板阻抗增加,不利大電流放電,且消耗鋰離子嵌入含量,使電容量降低,目前有效SEI 膜穩定劑為VC;2.電解液氧化分解:電池因過充電或在高電壓下,電解液分解產生氧氣及二氧化碳,容易使電池脹氣短路。
耐過充電解液
一般對於過充電保護所使用的添加劑為氧化還原梭添加劑及正極保護層添加劑。氧化還原梭多為芳香族延伸物,容易在過充電發生時,在正極發生氧化而產生陽離子,帶著正電荷傳遞到負極發生還原而獲得電子,再帶著電子回正極,如此反覆過程快速傳遞過充電荷。以芳香族為主是因為其具有π電子共軛,進行可逆氧化還原反應……以上內容為重點摘錄,如欲詳全文請見原文。
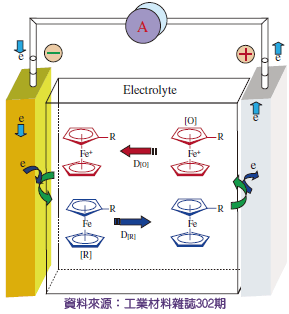
圖七、氧化還原梭耐過充添加劑反應機制
作者:葉定儒、陳金銘、廖世傑 / 工研院材化所
★本文節錄自「工業材料雜誌302期」,更多資料請見:https://www.materialsnet.com.tw/DocView.aspx?id=9925