隨著材料科學演進及醫學技術進步,單純天然來源之材料功能已漸漸不符合需求, 1970 年代開始應用高分子材料技術發展出以生物體可分解/ 吸收之高分子材料所製成的醫療產品並商業化,早期為聚甘醇酸(Poly Glycolic Acid; PGA),隨著分解時間不同之需求,陸續發展出聚乳酸(Poly Lactic Acid; PLA)、聚己內酯(Polyε-caprolactone; PCL)、聚酐(Polyanhydride)、聚原酸酯(Polyorthoester)及以上高分子之共聚合物。
依據Research and Markets 公司於2009 年所發布的市場調查報告指出,僅就全球生醫材料市場於2008 年已達到255 億美元,如果加上生醫材料所結合成之器材(Biomaterial Device),2008 年全球市場值達到1,154 億美元,預估年成長率(CAGR)以15% 速度成長。再者,依據MarketsandMarkets 公司於2010 年所進行的生醫材料市場分析指出,僅高分子類型全球生醫材料產值即達約75 億美元,預估2015 年全球可達約180 億美元的產值。
常見生物可吸收性高分子材料分類
一般生物可吸收性生醫高分子材料依來源可分為合成與天然高分子材料。合成高分子材料常見的醫學產品材料為多羥基酸類高分子,如PGA 、PLA 或PCL ,如表一所示。結構中常見之分解基團為含有羰基鍵結(Carbonyl Bond)並帶有氧(Oxygen)、氮(Nitrogen),以及硫(Sulfur)等基團,相關水解示意如圖二所示。當上述分解基團中X取代基為氧、氮、硫時,可於生物可吸收性高分子鏈中分別產生酯 (Ester)鍵、醯胺(Amide)鍵、硫酯(Thioester)鍵、亞醯胺(Imide)鍵或聚酐(Anhydride)鍵如圖三所示,因而於生物體內產生具生物可吸收性質。
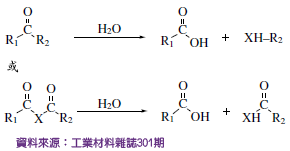
圖二、常見生物可吸收性高分子鏈水解示意
生物可吸收性高分子材料分解特性與機制
一般而言,分解性高分子材料最重要的分解機制為水解作用,而生物可吸收性材料如具有結晶性質,分子鏈之降解程序的第一階段為水分子進入非結晶區(Amorphous Region)針對分解基團進行水解作用(Hydrolysis),接著水分子才會進入結晶區域(Crystalline Region)進行較緩慢的水解作用,也因如此,除了各分解基團之水解半衰期外,結晶程度較低之分解性高分子材料通常具有較快水解之可能。此外,高分子鏈長愈長(分子量高)、環境溫度高、環境酸鹼值非中性,以及高表面積等因素都可能促使生物可吸收性材料分解速度加快。
工研院材化所之生物可吸收性高分子材料發展現況
針對人工合成之生物可吸收性高分子材料所遭遇的兩大瓶頸,工研院材化所已成功發展出一新形式生物可吸收性高分子材料。主要為利用分子微結晶調控技術,成功以化學合成方式調控分解性材料中結晶程度,以利於水分子之適當導入,達到調控分解速度之需求,如圖七(a)所示。而強度不足問題,則採用分子自我強化技術 (Modulus Self-Reinforced; MSR)之概念,如圖七(b)所示,於一般生物可吸收性高分子鏈中導入具有氫鍵結構分子,當氫與氧或氮形成共價鍵時,該鍵結之電子因吸引作用致使原子形成帶有負電荷狀態,如此將使氫形成H+ 狀態,進而能夠吸引鄰近負電度較高之氧或氮原子上的孤對電子(Lone Pair Electrons),使得氫原子與氮或氧原子之間產生類似鍵結狀態,而此氫鍵作用力一般具有約5~40 kJ/mole 的能量,因而有物理性分子強化力量存在。實際測試結果顯示,以該技術應用於PCL 材料之改質,強度最高可提高100% ,並累積取得台灣、歐洲、美國、中國大陸等多國10 餘件專利……以上內容為重點摘錄,如欲詳全文請見原文
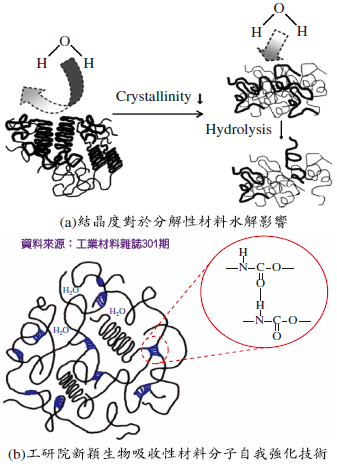
圖七、工研院新穎生物可吸收性材料之設計原理
作者:楊政典 / 工研院材化所