高分子微胞(Polymeric Micelle)為一具有核-殼型(Core-shell)形態的奈米球(圖一),藉由兩性高分子(Amphiphilic Copolymer)熱力學特性,在水溶液中為了降低系統的能量, 高分子會自組裝(Selfassembly)形成奈米尺寸的微胞,由於奈米微胞結構的獨特性及尺寸效應,使得奈米微胞在藥物傳送及基因治療等領域具備極大的應用潛力。其中,將奈米微胞做為藥物載體(Drug Carrier)控制藥物釋放的材料最受矚目。過去,利用高劑量的全身性藥物傳統治療癌症方法常常會造成不可避免的副作用而使病患產生極大的痛苦,因此學者提出標靶藥物投遞的概念,可使藥物有效且大量地經由血液循環累積於腫瘤組織,最終達到毒殺腫瘤細胞的目的。此種藥物控制釋放技術漸漸被現代醫學所重視,因為它可以增進療效、減低副作用、改善藥物的耐受性、提高服藥的便利性、維持較長的療效時程。其製備方法是將藥物溶解、陷入、附著於基材,或是利用基材將藥物包覆,形成奈米微粒、奈米球、奈米膠囊等。
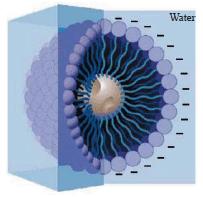
圖一、具核和殼型態的高分子微胞
兩性團鏈共聚物應用於藥物裝載與傳輸
高分子微胞的組成為一具可溶性之兩性(Amphiphilic)的分子鏈段所組成(圖二),其一端帶有親水鏈段(Hydrophilic Chain),另一端則帶有親油鏈段(Hydrophobic Chain),當兩性高分子溶解於水溶液中濃度超過臨界微胞濃度時,兩性高分子分子中之疏水鏈段會透過凡得瓦爾力(Van Der Waal Force)互相作用,結合形成一疏水基在內而親水基在外之微胞構造,其核心結構可為親油鏈段,外層(Layer)為親水鏈段或相反結構。
近年來兩性團鏈共聚物(Amphiphilic Block Copolymers)被廣泛運用於製藥學領域,包括連續藥物釋放應用、提高藥物穩定性與溶解度、降低多重抗藥性(Multidrug Resistance)的發生,以及基因載體的設計等方面。研究發現,兩性團鏈共聚物最大的優勢是當其在水溶液環境中,達到臨界微胞濃度(CMC)時,兩性團鏈共聚物會形成具有核殼結構(Core-shell Structure)的奈米尺寸高分子微胞,其疏水端所形成之核心部分提供疏水性藥物最佳的置放儲存場所。
高分子微胞在藥物載體之應用
當高分子微胞負載藥物穩定且準確到達欲治療的組織後,經由胞吞作用進入細胞,除此之外,這些奈米載體到達病灶(如癌)後,很快地在癌細胞間聚集並和細胞間交互作用,引發載體形態的改變,進一步加快局部藥物釋放的速率,進而達到藥物標靶(Target)傳遞與更有效地治療目的。微胞材料藉由生物體內環境改變的刺激,如溫度(溫度應答型微胞)、pH 值(酸鹼應答型微胞)或光照等,因而產生崩解將藥物釋放出來,以達到毒殺腫瘤細胞的目的。
綜合而論,高分子微胞應用於藥物釋放系統上的優點包括:在血液中具有較長的半衰期(Half-life)、不會長期累積在人體內、提高藥物載體的可溶性與結構穩定性、降低免疫性與蛋白質水解、疏水核心為一藥物儲藏庫、具有多種選擇性的控制釋放性質。
酸鹼應答型微胞
酸鹼應答型微胞對於所處環境之不同酸鹼值差異能產生變化,一般這類微胞具有可解離的基團,受環境pH 值的變化而酸解,使微胞結構崩解。近幾年,酸鹼應答型微胞在癌症治療上逐漸受到重視,有不少研究報導利用細胞內外pH 值差異或癌症組織較低之pH 值等特性設計微胞結構並包覆藥物,達到定點藥物釋放的目的。
酸鹼應答型微胞在酸性環境下的藥物釋放分為兩種型式,第一種是自組裝後形成的微胞,或者帶有可解離的基團在酸性環境下變得不穩定或改變本身的結構;第二種則是將藥物以酸敏感的化學鍵鍵結至高分子,使其可以在酸性環境被酸解而釋放出藥物。
1. Pullulan Acetate/Oligomeric Sulfadimethoxoine
You Han Bae 教授團隊發表利用改質的Pullulan Acetate (PA) (圖五)做為疏水性高分子鏈段以酯基連接Oligomeric Sulfadimethoxine (OSDM)。在pH = 7.4 的水溶液中形成一大小為50~60nm的微胞,當環境的pH 值下降至7.2~6.8 時, OSDM 會被解離至微胞的核,奈米微胞會經收縮改變內部的型態而使藥物釋放的速度更快;pH 值下降至6.8~6.2 時,在24 小時即可有效地將奈米微胞所包埋的抗癌藥物Doxorubicin(DOX)釋放出來。
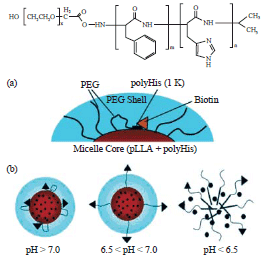
圖六、Poly(L-histidine-co-L-phenylalanine)
3. 利用可被酸解的化學鍵將藥物鍵結於奈米微胞結構上
此種具酸鹼應答的化學鍵較常見的有Hydrazone Bond、Acetal Bond、N-link Imidazole等,利用這些化學鍵將藥物鍵結於高分子奈米微胞結構上(圖七),形成一智慧型的藥物傳遞系統,被胞吞至細胞內以後,因為細胞內的一些胞器環境較酸,如Endosome (pH = 5.0~6.0)、Lysosome (pH =4.0~5.0),使得被具酸敏感的化學鍵鍵結於奈米微胞上的藥物得以藉由化學鍵的酸解而將藥物釋放出來,進而達到治癒療效……詳細全文請見原文
作者:周怡滿、楊璧菁、劉席瑋、楊政典、陳瑞祥/工研院材化所
★本文節錄自「工業材料雜誌275期」,更多資料請見:https://www.materialsnet.com.tw/DocView.aspx?id=8167